中檢院:細胞治療是醫藥領域的一場深刻變革
導 語
細胞治療作為生物醫學領域的前沿熱點,其快速的創新發展不僅關乎公眾健康,更深刻影響國家的生物安全。歐美、日本等發達國家已將此提升至國家戰略高度,并構建了完善的藥品監管體系以鞏固其在細胞治療領域的領先地位。

2024年8月,中國食品藥品檢定研究院(簡稱中檢院)、中國藥學會、南京醫科大學附屬蘇州科技城醫院的團隊在行業期刊《中國藥物評價》上發表了題為《國際細胞治療臨床研究發展現狀及監管政策研究》的報告。該報告全面梳理了全球主要國家及地區和我國的細胞治療臨床研究現狀,旨在為我國相關機構、企業及從業人員提供有價值的參考。中檢院團隊的報告開篇指出,創新是驅動生物醫藥產業邁向新質生產力發展的核心引擎。細胞和基因治療領域,不僅是技術進步的顯著標志,更是醫藥領域的一場深刻變革。作為創新醫療技術的典范——細胞治療產品及技術,自1990年Thomas 醫生因骨髓移植研究榮獲諾貝爾獎以來,已逐步從實驗室步入臨床應用階段,為患者帶來治療的新希望。盡管全球范圍內對細胞治療的定義尚未統一,但這并不妨礙它的迅猛發展,其定義因涉及的治療類型、目標疾病以及應用技術的多樣性而呈現差異。我國監管部門將細胞治療產品定義為用于治療人的疾病,來源、操作和臨床試驗過程符合倫理要求,按照藥品管理相關法規進行研發和注冊申報的人體來源的活細胞產品。
01
干細胞和免疫細胞治療
細胞治療的種類繁多,根據細胞來源可劃分為干細胞治療和免疫細胞治療等類別,根據供體來源不同分為自體、同種異體和異種細胞等。作為生命科學研究前沿應用技術,細胞治療在惡性腫瘤、遺傳性疾病及慢性退行性疾病等領域顯示出巨大的治療潛力。多款細胞治療產品已成功上市,并顯示出優異療效,其中干細胞療法以其較長的應用歷史和活躍的研究態勢顯得尤為突出。骨髓/造血干細胞療法是最早的干細胞療法,主要用于骨髓/造血干細胞移植,以治療白血病等血液系統惡性腫瘤。人源性干細胞及其衍生治療產品作為重要的再生醫學產品,在細胞替代、組織修復、疾病治療等方面具有巨大潛力。免疫細胞療法,是利用免疫細胞進行疾病治療的一種方法,最早主要應用于治療惡性腫瘤。1986年,美國科學家Ronsenberg發明的淋巴因子激活的殺傷(LAK)細胞,是最早具有廣泛臨床應用價值的免疫細胞療法。根據免疫細胞治療的特異性,通常可分為特異性免疫細胞治療和非特異性免疫細胞治療。特異性免疫細胞治療包括嵌合抗原受體T細胞治療(CAR-T)、T細胞受體嵌合T細胞治療(TCR-T)、嵌合抗原受體自然殺傷細胞治療(CAR-NK)、樹突狀細胞與細胞因子誘導的殺傷細胞聯合治療(DC-CIK)。非特異性免疫細胞治療主要包括淋巴因子激活的殺傷細胞治療(LAK)及細胞因子誘導的殺傷細胞治療(CIK)。此外,細胞外囊泡作為細胞衍生物,具有比活細胞更容易表征、儲存、包裝和運輸的非生命性質優勢,其研究已呈現爆發式增長。細胞外囊泡(EV)是細胞釋放到細胞外空間的脂質雙層膜性小泡的總稱,其直徑范圍為50~2000納米。其中外泌體(exosomes)為直徑為30-150納米的細胞外囊泡。目前,FDA至少已批準8個外泌體產品進入臨床Ⅱ期/Ⅲ期試驗。其中,Direct Biologics公司研制的ExoFlo(骨髓間充質干細胞來源EV)已經進入臨床Ⅲ期試驗。
02
大量資本進入細胞治療領域
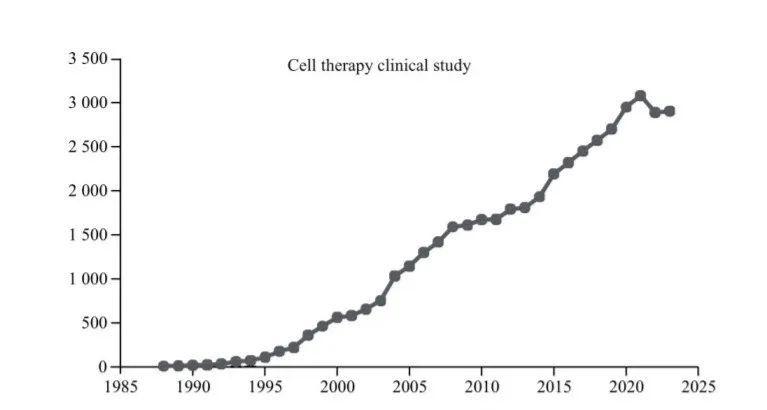
由于慢性病發病率上升、老年人口增加以及該領域的技術進步,全球細胞療法市場預計將大幅增長。根據Technavio 預計,2023~2027年全球細胞治療市場份額將增加到310.4億美元,復合年增長率為57.06%。2015 年以來,隨著細胞治療藥物的陸續獲批上市,大量資本進入細胞治療研發領域成為細胞治療行業加速發展的推動力。其中,2023年我國細胞治療研發融資事件數量為 47件,在所有藥物研發融資事件數量中居于首位。中檢院的報告統計了過去20多年間全球細胞治療臨床研究數量增長趨勢。截至2023年底,全球在美國臨床試驗注冊庫 clinicaltrials.gov 平臺上登記的細胞治療相關臨床研究項目已超過45000項,其中2021年新增總量已經超過3000項,2022年及2023年受疫情影響,項目數量略有下降,但仍年均超過了2800項(圖1)。
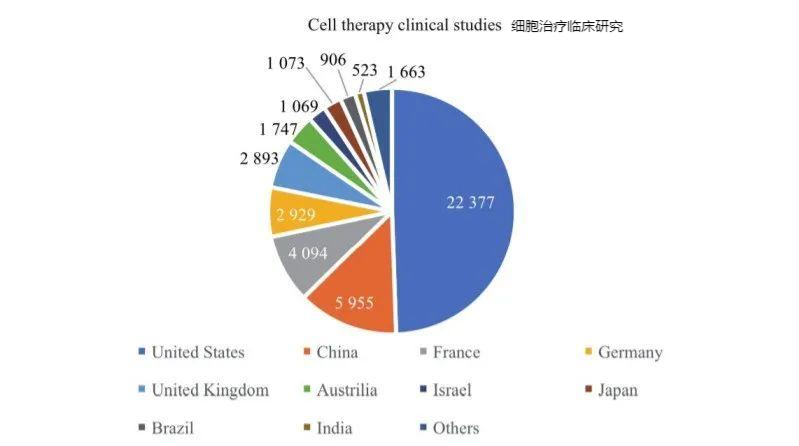
全球細胞治療研發集地域主要為北美(主要是美國)、東亞以及西歐。對美國、中國、法國、德國、英國、澳大利亞、以色列、日本、巴西、印度等國家或地區開展的各類細胞治療臨床研究進行了統計,美國和中國在全球細胞治療研發方面占據主導地位,適應證主要集中在腫瘤領域,并逐步向非腫瘤領域擴展。其中,美國開展細胞治療臨床研究約占全球1/2,超過22300項,中國接近全球1/7,全球排名第二,約6000項(圖2)。
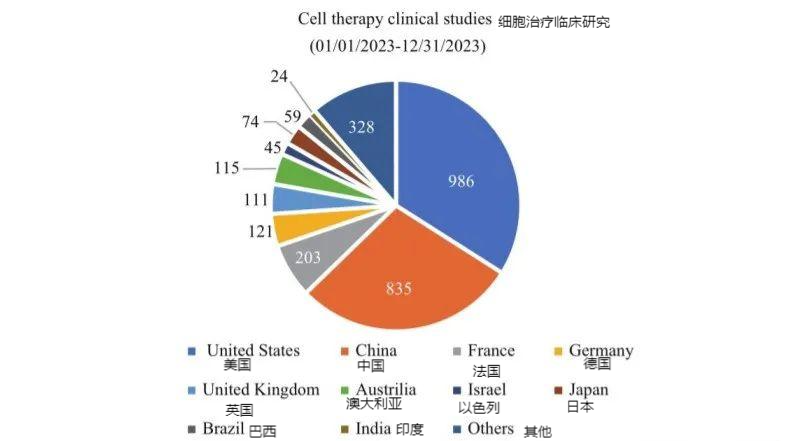
隨著我國生物醫藥健康產業提升成為國家戰略,細胞治療臨床研究數量不斷上升,已經躋身全球第一梯隊。2023年度全球細胞治療臨床研究2900余項,我國細胞治療臨床研究超過800項,約占全球數量30%,與美國(980余項)接近(圖3)。
干細胞臨床研究與全部細胞臨床研究情況類似,2023年度全球干細胞治療臨床研究約560項,我國細胞治療臨床研究超過130項,美國為約 160項。申報的適應證以腫瘤、心血管疾病、骨骼肌肉類疾病等慢性病為主。在具體領域技術方面,我國細胞治療研發水平與發達國家相比基本處于并駕齊驅階段,甚至在某些領域已經躍居國際前沿。我國在新興的 TCR-T 及 TIL等免疫細胞治療臨床研究數量方面已經持平或超過美國。2023 年度,全球TCR-T 臨床研究共 15 項,我國有 11 項,美國為4 項;全球TIL 臨床研究共74 項,我國有 20 項,美國 22 項。這些數據充分展示了我國在細胞治療領域,特別是免疫細胞治療方面的強勁發展勢頭和顯著成就。
中國關于細胞治療主要規范指南

在政產學研用等各方共同努力下,我國的細胞治療研發及監管水平基本與國際同步。特別是2017年以來,國家藥監局藥審中心(CDE)陸續發布30多項細胞及基因治療相關技術指南,形成了從研發、注冊、生產到上市后全生命周期的監管體系,為我國細胞治療成果轉化及產業規范發展提供了監管政策保障。
 魯公網安備37010002000272號
魯公網安備37010002000272號